QMS für die Life Science Branche
Das All-in-One Paket für Ihr Qualitätsmanagement
Ihr Qualitätsmanagementsystem (QMS) für hochregulierte Märkte
Für Unternehmen in streng regulierten Branchen stellt das Qualitätsmanagement eine tägliche Herausforderung dar. Um die Qualität der Produkte sicherzustellen, müssen viele Dokumente erstellt und sicher verwaltet werden. Und damit Sie sich wieder auf Ihr eigentliches Business konzentrieren können, unterstützt Sie unsere ISO-zertifizierte Qualitätsmanagement-Lösung unter Berücksichtigung der Regularien wie ISO 9001, ISO 13485, 21 CFR Part 11, EU Annex 11, GAMP 5, HIPAA und vielen mehr.
Eine zentrale Lösung für Ihr Qualitätsmanagement
Verwalten Sie alle Unterlagen sicher an einem Ort und haben eine Anwendung für alle Bereiche des Qualitätsmanagements – vom Risikomanagement, über das Abweichungsmanagement (Deviation Management) bis hin zum Veränderungsmanagement (Change Management). Out-of-the-Box liefert unsere Lösung Ihnen die gängigen vordefinierten Prozesse in Form von Workflows mit.
Das umfassende Qualitätsmanagementsystem basiert auf der M-Files Plattform und wird in der sicheren Microsoft Azure Cloud oder bei Ihnen On-Premise gehostet.
Einheitliche Dokumente & Prozesse
Die Erstellung und Freigabe von SOPs und ähnlichen Dokumenten ist dank Vorlagen und der Nutzung von vordefinierten Workflows so einfach wie noch nie. Die anfallenden Aufgaben werden automatisch an die verantwortlichen Personen weitergeleitet und mit einem Fälligkeitsdatum versehen. Bei der Aktualisierung wichtiger Dokumente werden die betroffenen MitarbeiterInnen automatisch über die neue Version benachrichtigt. So arbeitet keiner mehr nach veralteten Anweisungen.
Audits und Aufgaben immer im Blick
Auch für anstehende Audits sind Sie bestens vorbereitet. Alle Änderungen an einem im QMS abgelegten Dokument werden dokumentiert und bei jeder Revision legt das System automatisch eine neue Version an. So haben Sie für jedes Dokument jederzeit einen Audit-Trail.
Dank der zentralen Verwaltung aller Dokumente und Daten haben Sie bei einem anstehenden Audit alle benötigten Unterlagen mit wenigen Klicks bereit. Nach erfolgtem Audit können Sie die Befunde aufzeichnen und mit den entsprechenden Inhalten und verantwortlichen Personen verknüpfen. Die anstehenden Aufgaben können mit einer Bearbeitungsfrist versehen werden und schon verpassen Sie keine Deadline mehr!
Sie möchten mehr erfahren?
„Von den Anfängen der Dokumentenmanagement-Systeme bis hin zu den heute komplexer werdenden Ansprüchen an ein ECM habe ich schon unzählige Projekte begleitet und zum Erfolg geführt. Bei Fragen wenden Sie sich jederzeit an mich – ich nehme mir gerne Zeit für Sie!“
Jörg Eckhard – Leitung Vertrieb & ECM-Experte
Ihre Vorteile auf einen Blick
Einheitliche Prozesse
Definieren Sie Ihre Prozesse und dokumentieren Sie alle Schritte revisionssicher. Die Nutzung von Vorlagen und dynamischen Zugriffsrechten helfen Ihnen dabei.
Einheitliche Inhalte
Das QMS ist Ihre Lösung zum Erstellen und Organisieren von Dokumentationen, Änderungen und Nachweisen über den gesamten Entwicklungsprozess hinweg.
Mehr Transparenz
Managen Sie Nonkonformitäten (NCRs), Beschwerden, CAPAs und Audits zentral. Dokumente, Mails, Nachweise und andere Dateien können mit jedem Audit, Risiko und CAPA verknüpft werden.
Schulungsverwaltung
Weisen Sie Ihren MitarbeiterInnen automatisch wichtige Inhalte als Schulungsmaterial zu und informieren Sie sie über neue Unterlagen. Sie können auch Mitarbeitende ohne Zugang schulen.
Lieferantenmanagement
Definieren Sie den Prozess zur Auswahl geeigneter LieferantInnen und verwalten Sie die freigegebene Lieferantenliste mit den entsprechenden Produkten oder Materialien, die sie liefern dürfen.
Risikomanagement
Erstellen und verwalten Sie alle SOPs und stellen Sie sicher, dass alle MitarbeiterInnen sie auch befolgen. Des Weiteren können Sie alle Risiken im QMS verwalten und daraus vorbeugende Maßnahmen ableiten.Die wichtigsten Features
- Vordefinierte Prozesse & Workflows
- Detaillierte Audit-Trails
- Automatische Erstellung der Änderungshistorie
- Dynamische Vergabe von Zugriffsrechten
- Mobil, im Web und auf dem PC
- Microsoft Office Integration
- Vorlagenverwaltung
- Schulungsmanagement
- Elektronische Signaturen
Machen Sie sich ein Bild von unserer Lösung
Die Startoberfläche

Von der Startoberfläche des M-Files QMS aus haben Sie den direkten Zugriff auf alle qualitätsrelevanten Dokumente und Informationen sowie den Überblick über die Ihnen zugewiesenen Aufgaben und anstehende Termine.
Change-Requests
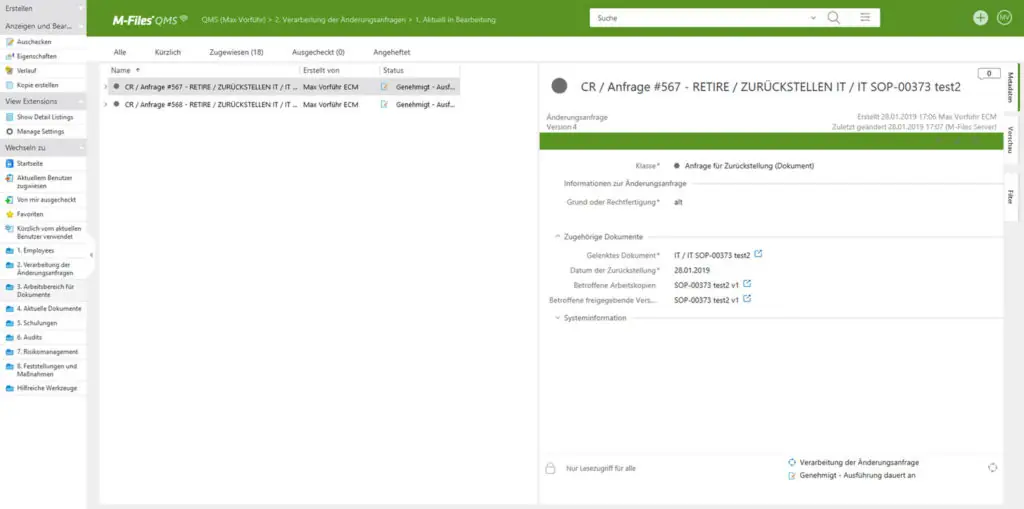
Ihre NutzerInnen können mit der Change-Request Funktion Änderungen an Dokumenten oder Prozessen beantragen. Darauf basierend kann die Bearbeitung angestoßen und über einen definierten Workflow durchgeführt werden.
Audit-Feststellungen

Verwalten Sie Ihre internen und externen Audits im M-Files QMS. Die Feststellungen lassen sich bequem in einer Eingabemaske erfassen, mit dem Audit verknüpfen und über einen Workflow beheben.
Die Startoberfläche
Eine SOP erstellen
Weitere Videos
Schauen Sie sich unsere weiteren Videos über die verschiedenen Funktionen des QMS auf Basis von M-Files an:
Im Detail: Die Gute Herstellungspraxis
Ein der Guten Herstellungspraxis (Good Manufacturing Practices – GMP) gerechtes Qualitätsmanagement umfasst Produktionsabläufe und -umgebung inklusive Kontrollen, die erforderlich sind, um Produkte auf hohem Qualitätsniveau zu produzieren und die Anforderungen der Gesundheitsbehörden für die Vermarktung zu erfüllen. Dabei entstehen große Datenmengen, die sicher verwaltet werden müssen. Und genau hier setzt unsere Lösung an:
Qualifizierung der Software
Bei der Qualifizierung der Software wird gezeigt, dass sich diese für den geplanten Zweck eignet und unter realen Bedingungen zuverlässig funktioniert. Sie teilt sich in IQ (Installationsqualifizierung) für die Inbetriebnahme der Software, OQ (Funktionsqualifizierung) als Test, ob die Software funktioniert und ob sie alle Anforderungen erfüllt, und PQ (Leistungsqualifizierung) zum Testen unter realen Bedingungen. Die Validierung können Sie in einer Validierungsumgebung vornehmen oder Validierungsskripte und Templates in Form von Word- oder PDF-Dokumenten verwenden.
Dokumentenmanagement
Sicheres Management der Anweisungen und Richtlinien wie SOPs, inklusive Versionshistorie und Workflows für Freigabe- und Aktualisierungsprozesse. Diese Dokumente werden im QMS gemäß der guten Dokumentationspraxis nachvollziehbar erstellt, archiviert und alle Änderungen an ihnen werden in einem Audit-Trail aufgezeichnet.
Änderungsmanagement
Änderungen von Prozessen oder Verfahren müssen vor dem Wirksamwerden begründet und freigegeben werden. Vorgenommene Änderungen werden über Workflows dokumentiert und nachvollziehbar gemacht. Über die Vergabe von Zugriffsrechten wird sichergestellt, dass nicht jeder Mitarbeitende Änderungen an qualitätsrelevanten Dokumenten vornehmen kann.
Schulungen der MitarbeiterInnen
Die Schulungen von MitarbeiterInnen werden durch die Erstellung von Lernregeln und dem automatischen Versenden von Lernaufforderungen automatisiert. Bei erfolgreicher Teilnahme bestätigt der / die MitarbeiterIn die Fertigstellung mittels elektronischer Signatur und es wird automatisch ein Schulungszertifikat erstellt. So haben Sie jederzeit den Überblick über den aktuellen Stand der Schulungen aller MitarbeiterInnen.
Risikomanagement
Jedes erkannte Risiko wird nach erwarteter Schadenshöhe, der Eintrittswahrscheinlichkeit und der Wahrscheinlichkeit des Bemerkens klassifiziert und mit den entsprechenden Präventivmaßnahmen verknüpft. In sogenannten dynamischen Ansichten können Sie sich alle Risiken nach den vergebenen Klassifikationen anzeigen lassen.
Interne Audits
Interne Audits müssen nach ISO 9001 in regelmäßigen Abständen durchgeführt werden. Hierbei hilft ein definierter Workflow, der die Verantwortlichen an die Durchführung erinnert und das Vorgehen der Audits automatisiert.
Abweichungsmanagement
Nonkonformitäten, also Abweichungen von SOPs und Herstell- und Prüfvorschriften, werden in M-Files dokumentiert und bewertet. Die sich daraus ergebenen Korrektur- und Präventivmaßnahmen (CAPAs) werden an die verantwortlichen Personen gegeben und die Erledigung der Aufgaben wird nachverfolgt.
Ergänzende Informationen
Produktinformation M-Files QMS
Laden Sie sich alle Informationen zum M-Files QMS bequem und kostenlos als PDF herunter.
Kostenloses Whitepaper
Erfahren Sie, wie Sie Qualität und Compliance durch effektives Informationsmanagement sichern können.


